A evolução da resistência quando o "feitiço" se vira contra o "feiticeiro"
- SPECO

- 8 de ago. de 2025
- 26 min de leitura
Atualizado: 11 de ago. de 2025
Por Teresa Avelar, Instituto Superior de Psicologia Aplicada, e Margarida Matos, Centro de Biologia Ambiental, Departamento de Zoologia e Antropologia, Faculdade de Ciências da Universidade de Lisboa, in Cadernos de Ecologia (3).
Introdução
O desenvolvimento da resistência de microorganismos a antibióticos e de insectos a insecticidas ilustra claramente a necessidade de tomar em consideração processos evolutivos (e não apenas processos ecológicos) quando o Homem interfere nos processos naturais. O combate às doenças infecciosas e às "pragas" ignorou, em geral, uma perspectiva evolutiva, do que resultaram graves problemas que se irão expor. A evolução da resistência é um dos melhores e mais bem documentados exemplos de evolução por selecção natural, sobretudo em bactérias e em organismos multicelulares, como os insectos, com tempos de geração relativamente curtos, constituindo um problema actual e futuro de manifesta gravidade. É assim pertinente fazer uma breve revisão dos fenómenos implicados na evolução da resistência.
Evolução da resistência a antibióticos
Os antibióticos naturais são compostos produzidos por microorganismos (bactérias e fungos) e por algumas plantas que, em doses muito baixas, são letais ou inibem o crescimento de bactérias e fungos. O primeiro antibiótico a ser utilizado pelo Homem foi a penicilina, produzida pelo fungo Penicillum, cuja acção bactericida foi descoberta por Alexandre Fleming em 1929. A penicilina só começou a ser produzida em grande escala em 1944, o que constituiu uma autêntica revolução na medicina, tornando tratáveis e curáveis doenças infecciosas que até aí eram frequentemente mortais: tuberculose, febre tifóide, pneumonias, meningites, etc. Posteriormente foram sendo descobertos outros antibióticos, produzidos por microorganismos (e.g. cefalosporinas, pelo fungo Cephalosporium; estreptomicinas, tetraciclinas, cloranfenicol, rifamicina, vancomicina, etc., produzidas por bactérias Streptomyces). Hoje em dia grande parte dos antibióticos resultam da modificação química de certas substâncias naturais, ou são totalmente sintéticos, como as sulfonamidas. Muitos dos progressos da medicina moderna só foram possíveis devido à protecção fornecida pelos antibióticos, e.g. tratamento de queimaduras graves, quimioterapia, cirurgias complexas, transplante de órgãos, etc.

Modo de acção dos antibióticos
Os antibióticos têm vários tipos de efeito sobre as bactérias (Neu, 1992; Madigan et al., 2000; Walsh, 2000; Fig 1):
Inibem as enzimas (transpeptidades) que são necessárias para a síntese da parede celular bacteriana, a qual inclui compostos químicos não presentes em organismos eucarióticos. As penicilinas e as cefalosporinas agem a este nível; a vancomicina actua sobre o substrato peptídico.
Interferem com a síntese de proteínas (geralmente afectando especificamente os ribossomas bacterianos): e.g. estreptomicinas (pouco usadas no presente), tetraciclinas e cloranfenicol.
Interferem com a síntese dos ácidos nucleicos (e.g. a rifamicina, que impede a transcrição do ADN em ARN, ou a ciprofloxacina, que inibe uma enzima necessária durante a duplicação do ADN).
Interferem com o metabolismo celular, e.g. as sulfonamidas inibem a síntese do ácido fólico.
Uso e abuso dos antibióticos
No auge da "era dos antibióticos" estes foram indiscriminadamente receitados durante demasiado tempo, inclusive para doenças tão pouco perigosas como constipações e gripes que, sendo de origem viral, não são dominadas por antibióticos. Por outro lado o seu emprego profilático generalizou-se em hospitais e em muitos casos de doença, sem sequer ter sido identificada a bactéria responsável (Levin & Anderson, 1999; Cohen, 2000). Por exemplo, segundo Levy (1998), um terço das receitas prescrevendo antibióticos nos Estados Unidos não são necessárias. Além disso, em muitos casos de má prática médica, os tratamentos com antibióticos são interrompidos indevidamente pelo paciente mal os sintomas desaparecem. Isso é patente no caso do tratamento da tuberculose (o qual deveria ser prolongado durante 6 a 12 meses), e.g. em diversos locais dos Estados Unidos (Fig. 2).

Dado que as bactérias têm um tempo de geração muito curto, da ordem de horas ou dias, podem responder muito rapidamente à pressão selectiva que a acção dos antibióticos representa. Dificilmente poderíamos ter criado condições mais favoráveis para a evolução da resistência. Por um lado, multiplicam-se as ocasiões em que bactérias contactam com antibióticos, devido à prescrição indiscriminada; por outro lado, a pressão selectiva que se exerce permite facilmente a sobrevivência de estirpes mesmo parcialmente resistentes, que não são eliminadas porque a aplicação do antibiótico é interrompida precocemente. Como refere Walsh (2000), o aparecimento de resistência não é uma questão de "se vai surgir", mas "quando". Em casos de cirurgia na cavidade abdominal, que pode ser invadida por Staphylococcus aureus, uma cultura desta bactéria pode-se alterar de susceptível à meticilina (penicilina semi-sintética) para resistente em 5-7 dias, e se nessa altura é aplicada vancomicina, surgem estirpes resistentes 14 dias mais tarde (Walsh, 2000).
Em resultado desta actuação existem, no presente, estirpes de bactérias patogénicas resistentes a praticamente todos os antibióticos correntes (Cohen, 1992; Neu, 1992; Levy, 1998): casos particularmente graves são a bactéria da tuberculose (Mycobacterium tuberculosis), espécies que causam doenças gastro-intestinais (Enterococcus spp., Salmonella spp.) e espécies de Staphylococcus, implicadas em muitas doenças, desde infecções da pele a problemas intestinais, etc. (Fig. 3).

Em 1941 todas as estirpes testadas de Staphylococcus eram susceptíveis à penicilina; em 1944 S. aureus já era capaz de degradar a penicilina. Hoje 95% das estirpes de S. aureus são resistentes a todas as penicilinas naturais. Muitas também são resistentes à meticilina, à estreptomicina e às tetraciclinas, sendo apenas susceptíveis à vancomicina (um dos antibióticos mais caros, que tem que ser injectado), embora já tenham surgido estirpes parcialmente resistentes a esta (Levy, 1998; Cohen, 2000). No caso de Mycobacterium tuberculosis, a incidência da tuberculose diminuiu espectacularmente nos países ricos e, embora menos drasticamente, nos países mais pobres, tendo sido considerada um problema praticamente "resolvido" na década de 70. No entanto, estirpes resistentes à estreptomicina haviam surgido um ano após a descoberta deste antibiótico (Davies, 1994), o que deveria ter servido de alerta. Nos anos 80, em parte devido ao aparecimento da SIDA, a incidência da tuberculose tornou a aumentar. Em 1992 a tuberculose matava 3 milhões de pessoas por ano, tantas como a malária e mais do que a SIDA (Bloom & Murray, 1992; Stokstad, 2000). Dado que um terço da população mundial está infectado com M. tuberculosis, está-se na presença de uma catástrofe potencial talvez mais grave do que a SIDA, o que não pode deixar de ser causa de forte preocupação e motivo de decisivas tomadas de acção à escala global...
Um exemplo que ilustra particularmente bem as consequências do abuso "preventivo" de antibióticos é que a maior proporção de estirpes resistentes ocorre em hospitais, sendo cada vez mais frequente a aquisição de infecções não são facilmente combatidas com antibióticos porque são precisamente devidas a estirpes resistentes (Ewald, 1994). Outro problema é que os antibióticos afectam bactérias inócuas ou benignas para o organismo. Algumas acabam por adquirir resistência e devido à alteração das relações competitivas entre elas, podem tornar-se nocivas em pacientes debilitados, como ocorreu com Enterococcus faecalis, Acinetobacter sp. e Xanthomonas sp. Todas estas espécies, anteriormente inócuas, podem causar septicémias, e além disso constituem "reservatórios" de resistências, a qual pode ser transferida para bactérias mais patogénicas (Levy, 1998).
Estas observações aplicam-se infelizmente a outros agentes patogénicas, não bacterianos. Por exemplo, o protozoário causador da malária, Plasmodium sp., também adquiriu resistência à maioria dos medicamentos correntemente utilizados, com a excepção do mais antigo de todos, o "qinghaosu" usado na China desde há 2000 anos, extraído da planta Artemisia annua, mas que só começou a ser utilizado fora da China a partir de 1979 (Brown, 1992). Na sua utilização original, os extratos da planta deviam variar de caso para caso, enquanto que uma utilização a grande escala do composto purificado irá provavelmente tornar mais fácil a eventual evolução da resistência.
Mecanismos de resistência
Os mecanismos que permitem às bactérias resistir à acção dos antibióticos incluem (Neu, 1992; Davies, 1994; Baquero & Blázquez, 1997; Madigan et al., 2000; Walsh, 2000):
Alterações da permeabilidade da membrana celular, de modo que o antibiótico não chega a penetrar na bactéria.
Modificações da parede celular, de modo que antibióticos como as penicilinas deixam de a afectar. Este processo pode ocorrer devido à modificação de proteínas que perdem a afinidade pelas penicilinas.
Produção de enzimas que degradam o antibiótico. Por exemplo, as penicilinas e as cefalosporinas têm em comum um "anel β-lactâmico", e as enzimas β-lactamases atacam esse anel.
Alteração química do "alvo" do antibiótico, como a modificação das proteínas ribossómicas afectadas pelas estreptomicinas e cloranfenicol, ou da enzima afectado pelas sulfonamidas.
Sobre-produção das enzimas afectados pelo antibiótico (outro modo de resistir às sulfonamidas).
Aumento da taxa de expulsão do antibiótico para fora da célula, através de sobreprodução de proteínas da membrana, que exportam o antibiótico para fora da célula, o que ocorre frequentemente no caso da resistência às tetraciclinas.
Por exemplo, as estirpes de S. aureus resistentes a antibióticos com modos de acção diferentes (como as penicilinas, as tetraciclinas e as estreptomicinas), possuem vários mecanismos de resistência: (a) têm proteínas com fraca afinidade pelas penicilinas; (b) possuem β-lactamases; (c) têm enzimas que degradam as estreptomicinas ou eliminam a sua afinidade pelos ribossomas; (d) têm proteínas capazes de expulsar as tetraciclinas.
Implicações da resistência
A variedade de mecanismos até aqui referidos pode servir para evidenciar o "oportunismo" da selecção natural. Muitos destes mecanismos provêm de genes que já existiam nas bactérias, provavelmente com funções que originalmente podiam não ter a ver com resistência a produtos tóxicos, mas eram usados no metabolismo celular. Também é possível que esses mecanismos tivessem sido úteis em interacções com organismos produtores de antibióticos na Natureza, ou mesmo seleccionados nos próprios produtores (Davies, 1994; Baquero & Blázquez, 1997). De qualquer modo, a presença destes genes conferiu um certo grau de resistência a um ou vários antibióticos. As bactérias parcialmente resistentes puderam multiplicar-se, e mutantes com variantes mais eficazes dos genes envolvidos (por vezes, simplesmente versões mais activas) aumentaram de frequência.
Um dos factores responsáveis pela rapidez do aumento da resistência foi a capacidade de muitas bactérias transmitirem genes a outras espécies, por vezes muito distantes filogeneticamente, através de plasmídeos e transposões (Levin & Lenski, 1983; Ochman et al., 2000). Os plasmídeos são elementos genéticos existentes no citoplasma das bactérias, independentes do cromossoma bacteriano, e que não só se multiplicam autonomamente a uma taxa superior à do cromossoma bacteriano (o que aumenta as probabilidades de mutações e a capacidade de disseminação destas), como podem ser transmitidos a espécies com as quais não há trocas de genes cromossómicos. Por exemplo, muitos dos genes que codificam a produção de enzimas β-lactamases são transportados em plasmídeos. Embora se tenham multiplicado após a utilização maciça de antibióticos, os plasmídeos com genes conferindo resistência já existiam anteriormente: foram isolados plasmídeos com estas características a partir de estirpes congeladas em 1946 (Madigan et al., 2000). É frequente os plasmídeos conterem vários genes, cada um codificando um mecanismo de resistência diferente. Além disso, é frequente observar-se que os genes conferindo resistência são eles próprios transposões, isto é, estão flanqueados por sequências de inserção, que lhes permitem ser inseridos em diferentes locais do genoma. Isto significa que os genes de resistência podem ser obtidos por inserção a partir de outros plasmídeos, ou mesmo a partir do cromossoma de outras bactérias. É assim possível a aquisição de múltiplos factores de resistência: por exemplo, os genes cromossómicos conferindo resistência em S. aureus são o resultado da inserção de transposões (Neu, 1992).
Uma consequência desta facilidade de "troca genética" nas bactérias é que estirpes que nunca estiveram directamente expostas a um antibiótico podem obter genes conferindo resistência. Por exemplo, é corrente fornecer antibióticos a animais em sistemas de criação intensiva, porque os animais assim tratados crescem mais rapidamente, possivelmente devido ao controlo de doenças infecciosas pouco visíveis, às quais os animais provavelmente só são susceptíveis devido às condições de stress crónico em que são mantidos (Webster, 1994). Como muitas das bactérias que infectam o gado não afectam os seres humanos, assume-se que qualquer resistência que surja nestas não terá consequências para doenças humanas (Bonner, 1997). No entanto, já houve casos em que salmonelas e Campylobacter isoladas em humanos provinham de gado alimentado com antibióticos, e casos esporádicos de estirpes patogénicas de Escherichia coli (uma bactéria comensal dos humanos), com resistência a antibióticos usados em animais (Walsh, 2000). Além disso, são utilizados antibióticos quimicamente semelhantes a certos antibióticos particularmente valiosos quando aplicados no Homem: na Dinamarca em 1993 foram usados 22 quilos de vancomicina na terapia humana e 19000 quilos de avoparcina (um composto quimicamente semelhante) nos animais, o que obviamente facilita o aparecimento de resistência em bactérias patogénicas (Davies, 1996). Recentemente, verificou-se que uma percentagem elevada de bactérias presentes em roedores selvagens (Clethrionomys glareolus e Apodemus sylvaticus) em Inglaterra, eram resistentes a um ou vários antibióticos (Gilliver et al., 1999). Esta observação implica que: (a) as bactérias que existem nos roedores, e que obviamente não estiveram em contacto directo com antibióticos, obtiveram os genes conferindo resistência a partir de outras espécies de bactérias; (b) os genes conferindo resistência não foram eliminados na ausência do antibiótico. Esta última observação é preocupante. Julgou-se inicialmente que os genes conferindo resistência tinham outros efeitos fenotípicos desvantajosos, o que explicava a sua raridade antes da utilização de antibióticos. Se assim fosse, na ausência do antibiótico a resistência passaria a ter custos, e por consequência bastaria remover um antibiótico da circulação durante um certo tempo para que as estirpes resistentes passassem a ser substituídas por estirpes susceptíveis. A aquisição "horizontal" de genes conferindo resistência entre estirpes com e sem contacto com o antibiótico deixaria também de ser um problema, por passar a ter custos selectivos. No entanto, os modelos matemáticos (ver revisão em Levin & Anderson, 1999) sugerem que o declínio da resistência após a remoção do agente selectivo é muito mais lento do que o seu aumento na presença do agente, porque os efeitos desvantajosos da resistência na ausência do antibiótico são muito menores do que as suas vantagens na presença deste. Portanto, para que a resistência diminua significativamente será necessário retirar o antibiótico da circulação durante muito mais tempo. Além disso, podem surgir mutações compensadoras, as quais, uma vez estabelecidas, tornam desvantajosa a perda da resistência, mesmo na ausência do antibiótico, como foi experimentalmente demonstrado em E. coli por Bouma & Lenski (1988). Neste caso, as mutações com pensadoras surgiram no cromossoma bacteriano. Como resultado destas, ao fim de 500 gerações (75 dias) as estirpes com plasmídeos resistentes ao cloranfenicol eram competitivamente superiores mesmo na ausência do antibiótico (ver também Davies, 1996; Morell, 1997).
Todos estes dados demonstram um facto evidente: a selecção natural é uma força muito eficaz e as bactérias evoluem rapidamente. Quaisquer recomendações visando a utilização racional de antibióticos só serão eficazes tendo em conta os processos evolutivos possíveis em bactérias. Análises através de modelos matemáticos ainda não permitem concluir se é melhor utilizar um único antibiótico ou alternar entre dois ou mais (Levin & Anderson, 1999). No entanto, algumas recomendações são evidentes. Em particular, há que minimizar a exposição de bactérias a antibióticos (i.e. deixar de os receitar indiscriminadamente), visto que os dados disponíveis indicam que a frequência da resistência é proporcional ao número de tratamentos (Levin & Anderson, 1999); além disso, uma vez iniciado um tratamento, deve ser levado até ao fim, visto que a exposição incompleta ou irregular a um antibiótico favorece a emergência de estirpes resistentes (Levy, 1998; Walsh, 2000). Também deveríamos deixar de os utilizar como promotores de crescimento em animais, visto que a exposição a longo prazo a doses baixas é um meio ideal para seleccionar estirpes resistentes (Davies, 1996; Levy, 1998).
Evolução da resistência a insecticidas
Algumas espécies de insectos são consideradas "pragas". A definição de praga é exclusivamente antropocêntrica: uma praga é uma espécie que causa prejuízos financeiros e/ou na saúde humana. A definição não tem necessariamente a ver com altos efectivos populacionais dos insectos (por exemplo, no caso de insectos vectores de agentes patogénicos, mesmo populações pequenas podem causar doenças) ou um grau elevado de dano infligido a colheitas. Por exemplo, no caso de muitas frutas, o "dano" causado pelos insectos é meramente "cosmético", i.e. no aspecto exterior do fruto, não afectando a quantidade de frutos colhida ou o seu conteúdo nutritivo.
Porque é que uma espécie ou população de insectos se torna uma praga?
1) Quando essa espécie ou população é introduzida para fora da sua área geográfica natural, com a consequente perda de predadores e parasitas, e possibilidade de aumento exponencial dos seus efectivos. Outra possibilidade é a introdução pelo Homem de um agente patogénico susceptível de ser transportado por insectos locais, que se tornam assim vectores perigosos: foi muito provavelmente o que ocorreu com a febre amarela e a malária, cujos agentes foram introduzidos na América devido ao tráfico de escravos oriundos das regiões tropicais de África (Diamond, 1997). Finalmente, o próprio insecto vector pode ser introduzido, como ocorreu com o mosquito Aedes albopictus, introduzido nas Américas nos anos 80, e capaz de transportar várias doenças (Schrag & Wiener, 1995).
2) Quando são introduzidas plantas para as quais é possível a transferência de insectos nativos, como aconteceu nos Estados Unidos no caso do escaravelho da batata (Leptinotarsa decemlineata), que se alimentava originalmente de outras plantas solanáceas.
3) Quando existem monoculturas geneticamente uniformes e sistemas de cultivo intensivo que não só favorecem a proliferação de qualquer espécie que as consiga utilizar, como eliminam as condições em que os predadores e parasitas dessa espécie conseguem completar o seu ciclo de vida (Matson et al., 1997; ver também Fig. 4).

Os insectos são capazes de recuperar rapidamente os seus efectivos quando dizimados por factores de mortalidade, como os insecticidas, dado o seu potencial reprodutor elevado. Este aspecto, aliado a um tempo de geração relativamente curto, com a possibilidade de várias gerações por ano, faz com que tenham óptimas condições para desenvolverem resistência.
Os insecticidas
A utilização de substâncias capazes de matar insectos é muito antiga e, até à década de 40, era essencialmente baseada quer em compostos inorgânicos, incluindo cobre, enxofre, chumbo ou arsénico (os dois últimos de muita elevada toxicidade para os seres humanos), quer em produtos insecticidas dos derivados de plantas (nicotina do tabaco e piretrosina dos crisântemos), muito pouco estáveis uma vez expostos à luz. O uso de insecticidas teve crescimento explosivo após o desenvolvimento de compostos sintéticos nos anos 40, principalmente os hidrocarbonetos clorinados como o DDT (cuja descoberta valeu ao químico suíço Müller o prémio Nobel em 1948) e os organofosfatos, altamente tóxicos, derivados de "gases de nervos", e que incluem o Malathion, o Parathion, etc. (e.g. o gás Sarin usado num atentado em Tóquio há uns anos). Ambos os tipos actuam sobre o sistema nervoso: o DDT sobre canais permeáveis ao sódio (essenciais para a propagação dos impulsos nervosos) e os organofosfatos inibindo a enzima colinesterase, a qual degrada o neutrotransmissor neuro-muscular acetilcolina. Em 1962, no seu famoso livro Silent Spring ("A Primavera silenciosa", simbolizando a destruição da Natureza), Rachel Carson foi a primeira a enumerar os efeitos nocivos do uso indiscriminado de insecticidas, como o DDT. Esses efeitos incluem:
1) Mortalidade de organismos que não eram o alvo original: insectos polinizadores, insectos predadores e parasitas da espécie-alvo, espécies de vertebrados, etc. Esta "mortalidade colateral" pode resultar em:
a) Aumento do efectivo populacional da praga para níveis superiores aos que ocorriam antes da aplicação do insecticida, visto que este eliminou os inimigos naturais da praga. A praga recupera muito mais rapidamente do que os seus predadores e parasitas, por várias razões: em primeiro lugar, os predadores e parasitas só podem multiplicar-se na presença da presa, enquanto que a presa cresce perfeitamente na ausência de inimigos; em segundo lugar, o potencial reprodutor da presa tende a ser maior do que o dos seus inimigos, o que lhe permite aumentar os seus efectivos e "escapar" a qualquer controlo exercido pelos seus inimigos (Fig. 5).
b) Aparecimento de "pragas secundárias", isto é, espécies que anteriormente não causavam danos, mas que, sem predadores e parasitas, passaram a ser tanto ou mais nocivas do que a praga original (Fig 5.). Por exemplo, no fim dos anos 70 na Califórnia, 24 das 25 pragas agrícolas mais importantes haviam sido "criadas" pela aplicação de insecticidas (Naylor & Ehrlich, 1997).

Face a estes fenómenos há a tendência de aplicar quantidades cada vez maiores de pesticida, o que agrava ainda mais o problema, colocando os agricultores numa verdadeira "corrida acelerada" aos insecticidas, que aliás é encorajada pelas empresas fabricantes de insecticidas. No presente, apesar do alerta que a publicação de Rachel Carson representou, são aplicadas anualmente cerca de 2,5 milhões de toneladas de insecticidas sintéticos nas colheitos. Frequentemente, menos de 0,1% do insecticida aplicado contacta com o alvo: o resto contamina o ambiente (Naylor & Ehrlich, 1997). Nem sequer é óbvio que a aplicação de insecticida seja necessária para que a produção se mantenha a níveis elevados (ao contrário do que proclamam as empresas produtoras de insecticidas): verificou-se em certas zonas das Filipinas que os agricultores que concordaram em não utilizar pesticidas não produziram menos arroz do que aqueles que utilizaram pesticidas, e além disso pouparam dinheiro (Madeley, 1994).
2) Efeitos ambientais nocivos diversos, principalmente (mas não só) no caso de insecticidas que persistem no ambiente, como o DDT. Estes aspectos podem causar danos directos às pessoas - estimativas apontam para quase 25 milhões de pessoas afectadas por ano (Naylor & Ehrlich, 1997) - contaminação da água e dos solos, acumulação ao longo das cadeias alimentares, resultando na mortalidade de predadores que não estiveram em contacto directo com o insecticida, etc.
3) Evolução da resistência, que iremos detalhar.
A evolução da resistência
Os insecticidas são inicialmente uma pressão selectiva muito intensa, visto que matam a maioria dos indivíduos (os que são susceptíveis). No entanto, existem quase sempre alguns indivíduos que, fortuitamente, são resistentes e não só sobrevivem como, uma vez libertos da competição intra-específica por recursos e da pressão de predadores e parasitas, podem multiplicar-se sem entraves. A contínua aplicação de insecticidas, muitas vezes em doses crescentes como resposta à resistência, leva ao longo do tempo, não só a um aumento da proporção de indivíduos resistentes, mas também a um aumento do grau de resistência (i.e. sobrevivem a concentrações maiores do insecticida: Fig. 6).

Há vários mecanismos de resistência, que podem surgir separadamente ou em combinação (Mallet, 1989; McKenzie & Batterham, 1994):
Alterações de comportamento que resultam em evitar o contacto com o insecticida. Por exemplo, algumas espécies de Anopheles em África passaram a pousar no exterior das casas, onde não ecra aplicado insecticida, em vez de ficarem no interior, onde as paredes eram tratadas.
Inibição da penetração do insecticida através da cutícula.
Aumento da taxa de excreção.
Detoxificação, i.e. conversão do insecticida em compostos inócuos, levada a cabo por enzimas chamadas oxidases de função mista, cuja componente final é o citocromo P-450, o qual se combina com a toxina e cataliza a sua oxidação.
Modificação molecular do "alvo" bioquímico sobre o qual o insecticida agia. Por exemplo, a resistência aos organofosfatos é devida a uma modificação, por enzimas esterases, da colinesterase, a qual deixa de ser inactivada. Estas esterases podem ser produzidas a taxas muito maiores do que nos indivíduos susceptíveis, porque os genes passam a existir em muitas cópias; e.g. 250 cópias do alelo esterase B, no mosquito Culex pipiens (Raymond et al., 1991). O facto dos insectos terem acesso a este "arsenal" de defesas explica-se pelo facto de terem acesso a este "arsenal" de defesas explica-se pelo facto de terem estado envolvidos, desde há 250 milhões de anos, numa interacção semelhante relativamente aos compostos mais ou menos tóxicos produzidos pelas plantas como meio de defesa contra eles (Ehrlich & Raven, 1964).
Os sistemas de detoxificação dos insectos poderão ter surgido como adaptação aos produtos do seu próprio metabolismo, mas posteriormente estes sistemas "pré-adaptaram" os insectos para lidar, quer com plantas, quer, recentemente, com insecticidas (Futuyma, 1983). Por exemplo, as oxidases de função mista (que também existem no fígado em vertebrados) são naturalmente induzidas por muitos compostos vegetais, e a sua modificação evolutiva para agir sobre insecticidas sintéticos foi relativamente simples e rápida.
A exploração da base genética da resistência pode permitir elucidar uma questão muito discutida em biologia evolutiva, a de saber qual é o papel relativo de poucos genes de grande efeito versus muitos genes de efeito menor em processos adaptativos (ver Orr & Coyne, 1992). No caso dos insectos, alguns autores defendem que, embora a evolução da resistência em laboratório seja de tipo poligénico (i.e. envolvendo vários genes), na Natureza é mais frequentemente devida a poucos genes de grande efeito (May, 1985; McKenzie & Batterham, 1994). Estes genes são dominantes, ou parcialmente dominantes, o que explica a rapidez do seu aumento (5-50 gerações). A selecção de genes de grande efeito é de esperar em populações muito grandes, expostas a uma forte pressão selectiva, como quando um insecticida mata 90% de uma população. Tais genes podem espalhar-se muito rapidamente, como ocorreu no caso do alelo da esterase B em Culex pipiens, cuja sequência ao nível do ADN é praticamente idêntica em todo o mundo (Raymond et al., 1991). Em experiências laboratoriais, a base da resistência tende a ser poligénica devido às pressões selectivas mais fracas e às populações mais pequenas envolvidas, como ocorre no caso da resistência de Drosophila melanogaster ao DDT: nas estirpes seleccionadas, verificou-se que todos os cromossomas têm genes conferindo resistência (Crow, 1957). É importante sublinhar que as mutações que dão origem à resistência ocorrem independentemente da exposição ao insecticida, como foi demonstrado em Drosophila melanogaster. Na população utilizada, cada família foi dividida em dois grupos, um exposto ao insecticida e outro que nunca foi exposto. Os grupos de irmãos e irmãs não expostos das famílias que mostraram ter maior resistência é que foram escolhidos como progenitores da geração seguinte. Este tipo de selecção foi perfeitamente eficaz (Maynard Smith, 1989).
Tal como no caso das bactérias e dos antibióticos, supôs-se que a existência de resistência nos insectos era desvantajosa na ausência do insecticida, o que nem sempre é o caso. De facto, quando um alelo de grande efeito é seleccionado, afecta frequentemente de modo negativo os sistemas que mantêm a constância fenotípica, mas face a uma pressão selectiva intensa, é de esperar que sejam favorecidos genes modificadores que atenuem os efeitos deletérios do alelo, como sugeriu Fisher (1930). Foi precisamente o que se verificou na mosca Lucilia cuprina, que ataca gado ovino na Austrália. Nesta, a resistência ao insecticida Diazinon, é devida a um único gene, Rop-1, situado no cromossoma 4 e que produz uma enzima com maior actividade contra organofosfatos. Inicialmente, os indivíduos resistentes tinham desvantagem relativamente a indivíduos susceptíveis em ambientes sem Diazinon, mas posteriormente passaram a ser igualmente viáveis devido a uma mutação de um gene no cromossoma 3, o Modifier (Clarke, 1997). Ou seja, a resistência pode ser, tal como nas bactérias, uma via sem retorno.
Extensão do problema
A evolução da resistência é o problema mais grave associado ao emprego indiscriminado de insecticidas: mesmo se se desenvolvessem insecticidas que não afectassem negativamente outras espécies, nem permanecessem nos ecossistemas, a sua utilização como método universal e exclusivo de controlo seria inevitavelmente inviabilizada porque os insectos-alvos evoluem e adquirem resistência.
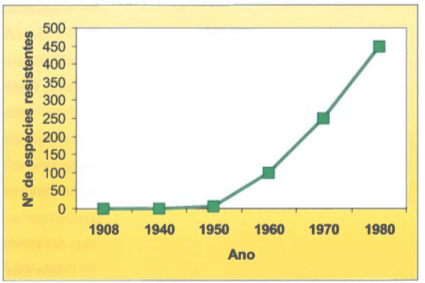
O DDT foi introduzido em grande escala em 1944: os primeiros sinais de resistência ocorreram em 1946, em moscas Musca do mestica na Suécia. Hoje, cerca de 500 espécies de insectos são resistentes a um ou mais insecticidas como um problemas ambientais mais graves, e a situação piorou desde essa data (Mallet, 1989). Por exemplo, o escaravelho da batata e mais cerca de 20 espécies de "super-pragas" são agora resistentes a todos os insecticidas de uso corrente. Nos Estados Unidos, o uso de insecticidas aumentou 10 vezes entre 1950 e 1985, mas a proporção das colheitas perdida devido a pragas (insectos, doenças, etc.) é essencialmente a mesma do que antes da era dos pesticidas (Naylor & Ehrlich, 1997). A malária, que se chegou a julgar "controlada" nos anos 50 e 60, ameaça 40% da população mundial. O seu ressurgir nos anos 70 deveu-se a vários factores (Brown, 1992): o abandono de programas de controlo (e.g. destruição dos charcos onde os mosquitos se reproduzem); a penetração em novas regiões onde existem os vectores e o parasita devida à desflorestação nas zonas tropicais; e a evolução da resistência aos insecticidas por parte das cerca de 30 espécies de mosquitos Anopheles que são vectores de Plasmodium (o qual também se tornou resistente aos medicamentos).
Insecticidas no futuro
Recentemente, têm-se apregoado as virtudes de alternativas a insecticidas sintéticos, como "reguladores de crescimento" (os quais perturbariam o ciclo de vida dos insectos) ou insecticidas microbianos, como aqueles constituídos por esporos da bactéria Bacillus thurigiensis ou B. t., e que são relativamente específicos (há estirpes de B. t. cujas toxinas matam respectivamente larvas de lepidópteroos, de mosquitos e de escarabídeos). Estas substâncias são muito menos nocivas para outros organismos, e para o ambiente em geral, do que os insecticidas convencionais. No entanto, do ponto de vista dos insectos-alvo, constituem simplesmente uma nova pressão selectiva, e será de esperar que surjam populações de insectos resistentes a estes compostos. De facto, várias espécies de lepidópteros já se tornaram resistentes a B. t., fenómeno que muitos especialistas do controlo de pragas haviam pensado que não poderia acontecer (Holmes, 1993; Hails, 2000). Como B. t. se degrada rapidamente, tem-se investido no desenvolvimento de plantas transgénicas exprimindo genes que produzem a endotoxina de B. t.. É provável que tal solução também não seja duradoura, dado que a expressão permanente da toxina constitui uma pressão selectiva particularmente intensa. Uma possível solução para o problema das "pragas" terá que incluir:
1) Um bom conhecimento da ecologia do sistema, de modo a poder aplicar métodos de controlo alternativos (e.g. protecção integrada), e que no fundo consistem em evitar as condições que transformam espécies inofensivas em pragas (introdução de espécies exóticas, monoculturas, etc; ver Matson et al., 1997). A protecção integrada inclui (ver Kogan, 1998): escolha de estirpes de plantas resistentes; escolha de épocas mais apropriadas para a plantação; utilização de culturas mistas; rotação de culturas de modo a evitar a permanência de "pragas"; utilização de culturas que sirva de "chamariz" para atrair as "pragas" para fora da cultura economicamente valiosa; monitorização dos efectivos das potenciais pragas durante o período em que as culturas são mais vulneráveis; controlo biológico por parasitas e predadores; e eventual utilização de insecticidas quando os efectivos dos insectos nocivos ultrapassam um determinado nível. Como tal, é um método mais moroso e complexo do que simplesmente aplicar insecticida. Um dos primeiros exemplos foi o caso do vale de Cañete no Peru. Sendo uma zona rica, que se converteu à monocultura do algodão nos anos 40, investiu muito cedo em insecticidas. No início, a produção aumentou, assim como as aplicações de insecticidas, que chegaram a ocorrer 40 vezes por estação, constituindo 30% dos custos de produção. Em 1956 haviam desaparecido a maioria das outras espécies, não havia aves e mesmo os animais domésticos haviam morrido. Nesse ano, as pragas destruíram 70% da colheita de algodão. Foi então introduzido um programa introduzido um programa de protecção integrada, que levou à diminuição do uso de insecticidas para apenas 2 a 5% dos custos de produção. A protecção integrada funcionou igualmente para o cultivo de batatas por pequenos agricultores em zonas pobres do Peru, embora esteja de novo ameaçada devido à instabilidade política e aos esforços das empresas produtoras de insecticidas (Sattaur, 1988; Naylor e Ehrlich, 1997).
2) Redução do uso de qualquer insecticida, a não ser quando absolutamente indispensável. Por exemplo, como vimos, são frequentemente utilizados insecticidas apenas para que os frutos não apresentem qualquer "defeito", porque os consumidores dos países ricos os rejeitariam de outro modo. A redução destas aplicações por razões "cosméticas" não traria prejuízos para os agricultores se os consumidores fossem devidamente educados quanto às consequências ambientais das suas exigências de "perfeição".
3) Conhecimentos de biologia evolutiva, de modo a reduzir o mais possível a intensidade da pressão selectiva favorecendo a resistência. Por exemplo, uma hipótese plausível que parece poder adiar a evolução da resistência é a aplicação simultânea, quando se verificar imprescindível de vários insecticidas diferentes, visto que a probabilidade de ocorrerem na população anteriormente não exposta, de indivíduos com vários mecanismos de resistência diferentes, devidos a genes diferentes, muito mais baixa do que a ocorrência de um único mecanismo. Se a aplicação desses vários pesticidas for limitada no espaço e no tempo haverá um reservatório de indivíduos susceptíveis com os quais os multi-resistentes poderão acasalar, e a recombinação poderá reduzir a sua frequência (Mallet, 1989). Note-se, no entanto, que isto só ocorrerá se os mecanismos de resistência forem devidos a genes diferentes: se um único gene resultar na protecção simultânea contra vários pesticidas diferentes, a utilização de diferentes insecticidas favorecerá os indivíduos com este tipo de resistência múltipla. O que não se pode esperar é a existência de uma solução simples e única, uma "poção mágica" que controle definitivamente insectos e microorganismos, cujos efeitos nocivos são, aliás, muitas vezes resultado da acção humana.
Conclusões
A evolução da resistência constitui um alerta para os perigos da intervenção irresponsável do Homem nos processos naturais. É, além disso, um exemplo claro da selecção natural, pelo que deveria ser analisada e, inclusivamente, divulgada ao nível do ensino. No âmbito da ecologia aplicada é pertinente apontar o seguinte:
1) Em primeiro lugar, o facto dos processos evolutivos poderem ser muito rápidos ainda é relativamente pouco divulgado. Muitos ecólogos tendem ainda a considerar que as escalas de tempo dos processos ecológicos e evolutivos são tão diferentes que a escala evolutiva pode ser ignorada numa análise de fenómenos ecológicos. Mas a rapidez da resposta de microorganismos ou de insectos ilustra bem a necessidade de ter em conta a evolução. Existem outros exemplos mais "naturais" (i.e. sem envolverem compostos aplicados pelo Homem) com respostas evolutivas muito rápidas (Thompson, 1998). A medicina não poderá continuar a avaliar tratamentos sem tomar em consideração as respostas evolutivas por parte dos organismos patogénicos, quer no que respeita a antibióticos, quer, inclusivamente, relativamente a diferentes comportamentos humanos que poderão ou não favorecer a transmissão (Ewald, 1994). Do mesmo modo, a agricultura, para ser sustentável, não pode ignorar o problema da evolução da resistência aos pesticidas (e os outros efeitos nocivos destes) nas suas estratégias de produção (Matson et al., 1997).
2) Em segundo lugar, e como reforço a (1), será de esperar que a resistência a toxinas por parte de qualquer organismo com efectivos populacionais inicialmente elevados, ciclo de vida curto e grande potencial reprodutor, evolua de forma particularmente rápida. Ou seja, não só em insectos, como noutros organismos, em particular, noutras "pragas". Por exemplo, as ratazanas Rattus norvegicus desenvolveram resistência ao veneno Warfarin, um anticoagulante que começou a ser usado nos anos 40 (May, 1985). Esta resistência é devida a uma mutação dominante R. Inicialmente, os portadores de R tinham desvantagens na ausência de Warfarin porque tinham uma elevada necessidade de vitamina K, e eram mais pequenos, perdendo em lutas de dominância. Mas, recentemente, foram encontrados indivíduos resistentes e de tamanho normal, ou seja, em que ocorreram alterações que eliminam a desvantagem de R, mesmo na ausência de Warfarin (Mundell, 1993).
3) Em terceiro lugar, a evolução da resistência não é inevitável se todos os organismos envolvidos forem capazes de evoluir. No caso da utilização de biocidas pelo Homem (quer antibióticos, quer insecticidas), apenas os alvos evoluem, sendo os biocidas estáticos, e, inclusivamente, purificados, portanto completamente uniformes. Mas os organismos que produzem antibióticos têm, presumivelmente, vantagens em continuar a fazê-lo, o que signfica que os seus alvos não se tornaram resistentes. E não se tornaram resistentes porque tanto o alvo como o produtor de antibióticos coevoluem. Um exemplo deste fenómeno foi descrito em formigas (do grupo taxonómico Attini) cultivadoras de fungos, os quais são usados para digerir as folhas que as formigas recolhem e que não conseguem elas próprias digerir. Os fungos cultivados são parasitados por outro fungo, nocivo, do género Escovopsis. As formigas são hospedeiras de uma bactéria do género Streptomyces, a qual produz antibióticos que atacam Escovopsis. O sistema formigas-fungos-Streptomyces parece existir desde há 50 milhões de anos, e, no entanto, Escovopsis não desenvolveu resistência aos antibióticos de Streptomyces, muito provavelmente porque quer Escovopsis, quer Streptomyces, podem evoluir (Currie et al., 1999). Há todo o interesse em compreender a dinâmica desta interação, o que só será possível se o ambiente em que ela ocorre (as florestas tropicais da América do Sul) continuar a existir.
Os processos mais eficazes no combate inteligente, quer a agentes patogénicos, quer a "pragas", têm de ter em conta a Ecologia e a Evolução, mesmo que resultem em menor lucro a curto prazo. A longo prazo, não se ganha, certamente, à Natureza, ignorando sistematicamente os seus processos. De facto, as melhores protecções contra pragas e agentes patogénicos são a manutenção e o conhecimento adequado da Biodiversidade.
Referências
Baquero, F. & Blázquez, J. 1997. Evolution of antibiotic resistance. TREE 12: 482-487.
Bloom, B. R. & Murray, C. J. L. 1992. Tuberculosis: commentary on a reemergent killer. Science 257: 1055-1064.
Bonner, J. 1997. Hooked on drugs. New Scientist 153 (2065): 24-27.
Bouma, J. E. & Lenski, R. E. 1988. Evolution of a bacteria/plasmid association. Nature 335: 351-352.
Brown, P. 1992. Who cares about malaria? New Scientist 136 (1845): 37:41.
Carson, R. 1962. Silent Spring. Houghton-Mifflin, Boston.
Clarke, G. M. 1997. The genetic and molecular basis of developmental stability: the Lucilia story. TREE 12: 89-91.
Cohen, M. L. 1992. Epidemiology of drug resistance: implications for a post-antimicrobial era. Science 257: 1050-1055.
Cohen, M. L. 2000. Changing patterns of infectious disease. Nature 406: 762-767.
Crow, J. F. 1957. Genetics of insect resistance to chemicals. Ann. Rev. Entomol. 2: 227-246.
Currie, C. R., Scott, J. A., Summerbell, R. C. & Malloch, D. 1999. Fungus-growing ants use antibiotic-producing bacteria to control garden parasites. Nature 398: 701--704.
Davies, J. 1996. Bacteria on the rampage. Nature 383: 219-220.
Diamond, J. 1997. Guns, germs and steel. Jonathan Cape, London.
Ehrlich, P. R. & Raven, P. H. 1964. Butterflies and plants: a study in coevolution. Evolution 18: 586-608.
Ewald, P. W. 1994. The evolution of infectious disease. Oxford University Press, New York.
Fisher, R. A. 1930. The genetical theory of natural selection. Clarendon Press, Oxford.
Futuyma, D. J. 1983. Evolutionary interactions among herbivorous insects and plants. In: Coevolution, Futuyma, D. J. & Slatkin (Eds.), Sinauer Associates, Sunderland Massachusetts, pp. 207-231.
Gilliver, M. A., Bennett, M., Begon, M., Hazel, S. M. & Hart, C. A. 1999. Antibiotic resistance found in wild rodents. Nature 401: 233-234.
Halls, R. S. 2000. Genetically modified plants - the debate continues. TREE 15: 14-18.
Holmes, B. 1993. The perils of planting pesticides. New Scientist 139 (1888): 34-37.
Kogan, M. 1998. Integrated pest management - historical perspectives and contemporary developments. Ann. Rev. Entomol. 43: 243-270.
Levin, B. R. & Anderson, R. M. 1999. Population biology of anti-infective chemotherapy and the evolution of drug resistance: more questions than answers. In: Evolution in health and disease, Stearns, S. C. (Ed.), Oxford University Press, Oxford, pp. 125-137.
Levin, B. R. & Lenski, R. E. 1983. Coevolution in bacteria and their viruses and plasmids. In: Coevolution, Futuyma, D. J. & Slatkin (Eds.), Sinauer Associates, Sunderland, Massachusetts, pp. 99-127.
Levy, S. B. 1998. The challenge of antibiotic resistance. Scientific American 275: 32-39.
Madeley, J. 1994. Beyond the pestkillers... New Scientist 142 (1924): 24-27.
Madigan, M. T., Martinko, J. M. & Parker, J. 2000. Brock Biology of microorganisms. Prentice Hall, New Jersey.
Mallet, J. 1989. The evolution of insecticide resistance: have the insects won? TREE 4: 336-340.
Matson, P. A., Parton, W. J., Power, A. G. & Swift, M. J. 1997. Agricultural intensification and ecosystem properties. Science 277: 504-509.
May, R. 1985. Evolution of pesticide resistance. Nature 315: 12-13.
Maynard Smith, J. 1989. Evolutionary genetics. Oxford University Press, Oxford.
McKenzie, J. A. & Batterham, P. 1994. The genetic, molecular and phenotypic consequences of selection for insecticide resistance. TREE 9: 166-169.
Morell, V. 1997. Antibiotic resistance: road of no return. Science 278: 575-576.
Mundell, I. 1993. Fat rats love their poison. New Scientist 139 (1882): 10.
Naylor, R. L. & Ehrlich, P. R. 1997. Natural pest control services and agriculture. In: Nature's services, Daily, G. C. (Ed.), Island Press, Washington, pp. 151-174.
Neu, H. C. 1992. The crisis in antibiotic resistance. Science 257: 1064-1073.
Newman, E. 1993. Applied ecology. Blackwell Scientific Publications, Oxford.
Ochman, H., Lawrence J. G. & Groisman, E. A. 2000. Lateral gene transfer and the nature of bacterial innovation. Nature 405: 299-304.
Orr, H. A. & Coyne, J. A. 1992. The genetics of adaptation: a reassessment. Am. Nat. 140: 725-742.
Raymond, M., Callaghan, A., Forte, P. & Pasteur, N. 1991. Worldwide migration of amplified insecticide genes in mosquitoes. Nature 350: 151-153.
Sattaur, O. 1988. A new crop of pest controls. New Scientist 119 (1621): 48-54.
Schrag, S. J. & Wiener, P. 1995. Emerging infectious disease: what are the relative roles of ecology and evolution? TREE 10: 319-324.
Stokstad, E. 2000. Drug-resistant TB on the rise. Science 287: 2391.
Thompson, J. N. 1998. Rapid evolution as an ecological process. TREE 13: 329-332.
Walsh, C. 2000. Molecular mechanisms that confer antibacterial drug resistance. Nature 406: 775-781.
Webster, J. 1994. Animal Welfare. Blackwell, Oxford.




Comentários